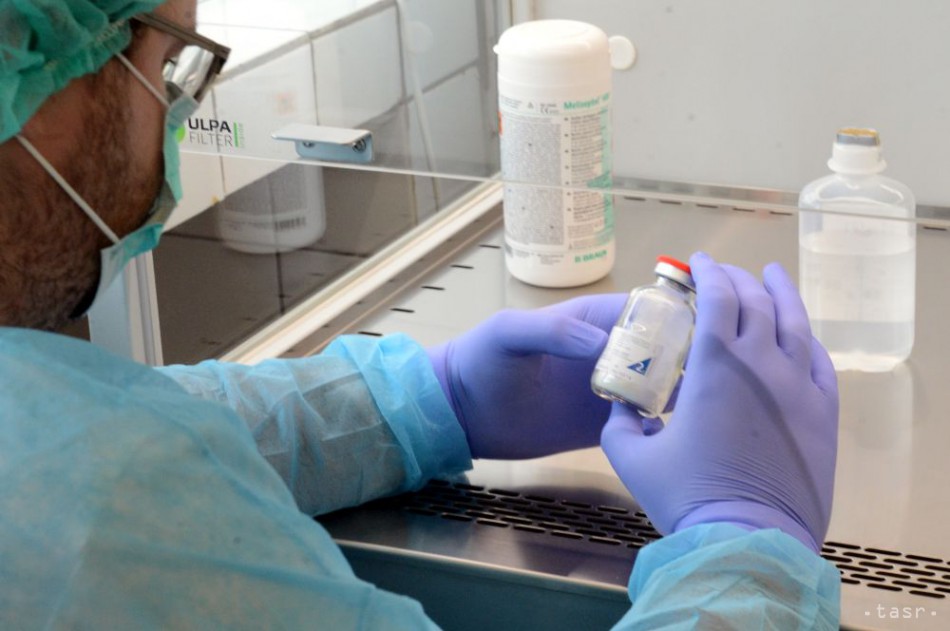
Bratislava 10. augusta (TASR) - Biosimilars, teda biologicky podobné lieky sa stávajú jednou z tém aj v slovenskej liekovej politike. Viaceré originálne biologické lieky strácajú svoju patentovú ochranu a stávajú sa tak predmetom záujmu farmaceutických firiem, ktoré chcú vyrobiť ich ekvivalenty. Tie majú nižšiu výrobnú cenu ako originály. Dôvodom je, že firmy nemusia predtým investovať do vývoja a testovania miliardy eur.
Desiatky biosimilars sú registrované aj na Slovensku. Ako pre TASR uviedla hovorkyňa Štátneho ústavu pre kontrolu liečiv (ŠÚKL) Magdaléna Jurkemíková "platnú registráciu má v súčasnosti 50 liekov s právnym základom biosimilars, teda ide o liek podobný s biologickým referenčným liekom. Biologicky aktívnych liekov máme ešte ďalších 33. Dokopy teda máme registrovaných 83 biologických liekov."
Viaceré biologicky podobné lieky sú už hradené aj zdravotnými poisťovňami. Podľa ministerstva zdravotníctva je z verejného zdravotníctva hradených 25 liekov označených ako biosimilars.
Biologické lieky sa nemôžu pri liečbe automaticky zamieňať ako tie chemické, ktoré sa na Slovensku majú predpisovať genericky. "Ministerstvo zdravotníctva (MZ) SR v rámci legislatívnych aktivít neupravovalo generickú preskripciu biosimilars. Platí, že pacient má možnosť voľby medzi originálnym liekom a generikom. U ostatných liekov je voľba medzi originálnym liekom a generikom v rukách lekára. Rovnako je to aj v prípade voľby medzi biologicky aktívnym liekom a biologicky podobným liekom. Iné usmernenia v oblasti biologicky aktívnych liekov a biologicky podobných liekov legislatíva neupravuje," priblížilo ministerstvo.
Biologické lieky vrátane biologicky podobných liekov pochádzajú zo živých organizmov, ako sú živé bunky, ktoré boli upravené pomocou biotechnológie, vysvetľuje Európska agentúra pre lieky (EMA). To umožňuje týmto živým organizmom alebo bunkám vytvoriť účinnú látku biologického lieku. Následne sa táto účinná látka získa z buniek. Účinné látky, napríklad proteíny, sú zvyčajne väčšie a zložitejšie než účinné látky nebiologických liekov. Biologické lieky sa od 80. rokov minulého storočia vyvíjajú pre rôzne ochorenia. K dostupným biologickým liekom patria aj hormóny ako inzulín a rastový hormón a aj monoklonálne protilátky na liečbu autoimunitných a nádorových ochorení.
Biologicky podobný liek je vyvinutý tak, aby bol veľmi podobný existujúcemu biologickému lieku. Existujúci biologický liek je liek, ktorý už bol schválený a používa sa v Európskej únii (EÚ), pričom sa označuje ako referenčný liek. Po tom, ako vyprší patent k referenčnému lieku a skončí sa obdobie, keď je liek týmto patentom chránený, môže prísť na trh biologicky podobný liek.
EMA tiež informuje, že biologicky podobné lieky nie sú totožné s generickými liekmi. Generický liek obsahuje presne tú istú molekulu ako existujúci nebiologický liek, napríklad aspirín. Je to preto, lebo na rozdiel od nebiologických liekov nemožno biologické lieky presne skopírovať. Tiež nemajú nič spoločné s doplnkovými alebo prírodnými liekmi, ani s rastlinnými liekmi.
Novela zákona zhoršila dostupnosť biosimilárnych liekov, tvrdia poisťovne
Novela zákona o rozsahu a podmienkach úhrady liekov, zdravotníckych pomôcok a dietetických potravín účinná od začiatku roka zhoršila podmienky dostupnosti biosimilárnych, t.j. biologicky podobných liekov pre slovenských pacientov. Biosimilárne lieky pritom predstavujú potenciál na zníženie nákladov z verejných zdrojov na zabezpečenie prístupu k rovnakému liečivu za nižšiu cenu. Zhodli sa na tom všetky tri zdravotné poisťovne.
Vstup biologicky podobných liekov do systému úhrad mal podľa štátnej Všeobecnej zdravotnej poisťovne (VšZP) predstavovať možnosť, ako zabezpečiť udržateľnosť financovania tejto liečby a zabezpečiť jej dostupnosť pre pacientov. "V reálnej praxi musíme konštatovať, že toto regulačné opatrenie neprinieslo očakávaný efekt a držitelia registrácie biosimilars za podmienok, ktoré stanovil zákon, nie sú ochotní vstupovať do systému úhrad," uviedla pre TASR hovorkyňa VšZP Viktória Vasilenková.
"Rozsah úhrady liekov je definovaný zákonom a pre VšZP je záväzný. V zozname kategorizovaných liekov majú svoje miesto aj biologické lieky (originály), ktoré majú stanovené podmienky úhrady z prostriedkov verejného zdravotného poistenia a v súlade s uvedenými podmienkami ich VšZP hradí," priblížila Vasilenková.
Branislav Cehlárik zo zdravotnej poisťovne Dôvera vysvetlil, že "z pohľadu nákladov na prostriedky verejného zdravotného poistenia má zdravotná poisťovňa Dôvera rovnaké náklady v prípade originálneho lieku, ako aj jeho náhrady." Oba lieky uhrádza v rovnakej výške.
Súčasná legislatíva podľa jeho slov teoreticky umožňuje vstup tzv. biosimilárov do slovenského úhradového systému, no stanovuje pomerne komplikované a nevýhodné podmienky, ktoré obmedzujú a spomaľujú vstup samotných biosimilárov na slovenský trh. "Ak vstúpi do kategorizácie biosimilárny liek, má to za následok automatické zníženie úhrady originálneho lieku na úroveň prvého biosimilárneho lieku," doplnil.
Union zdravotná poisťovňa v súčasnom období neplánuje žiadne zmeny v úhrade biologických, respektíve biologicky podobných liekov z verejného zdravotného poistenia, uviedol pre TASR jej hovorca Matej Neumann.
Na Slovensku je v súčasnosti registrovaných 50 biologicky podobných liekov. Zo zdravotného poistenia je v súčasnosti z nich podľa ministerstva zdravotníctva hradených 25.
Biosimilárne lieky, rovnako ako biologické lieky, pochádzajú zo živých buniek, ktoré boli biotechnologicky upravené. To umožňuje vytvoriť účinnú látku, ktorú tieto bunky produkujú. Účinnou látkou sú zvyčajne proteíny, ktoré sú väčšie a zložitejšie než účinné látky nebiologických liekov, ktoré sa vyrábajú chemickou syntézou. Vstup biosimilárnych, t.j. biologicky podobných liekov na trh v Európskej únii schvaľuje Európska agentúra pre lieky (EMA).